0前言
生物酶精练工艺作为节能降耗、无污染的印染清洁生产工艺[1],近年来受到国内外的普遍关注。它作用条件温和,耗水量和排放废水COD值低,对棉纤维损伤小,是目前公认的碱煮练的理想替代工艺,显示出很好的应用前景。然而,酶精练工艺对棉织物中的非纤维素杂质,如蜡质和果胶质,尤其是棉籽壳的去除效果较差,限制了其工业化应用[2,3]。
木聚糖是植物半纤维素的主要成分,为自然界中广泛存在、含量仅次于纤维素的可再生多糖资源,占细胞干重的7%~35%[4]。木聚糖酶是一类可将木聚糖降解成低聚糖和木糖的复合酶系。它以内切方式降解木聚糖主链架的β-1,4-木糖苷键,其水解产物主要是木二糖和木寡糖,少量的木糖和阿拉伯糖。木聚糖酶对棉籽壳的主要组分半纤维素有专一的降解作用。因此,提高木聚糖酶对棉籽壳的降解作用,能够最大程度地提高复合酶对棉籽壳的降解效果。
酶活是衡量酶生物活性的重要指标,但目前尚无木聚糖酶酶活测定的标准方法。常用的DNS(3,5-二硝基水杨酸)法[5],采用比色法测定还原糖的生成量,从而获得木聚糖酶的活力[6]。木聚糖酶水解木聚糖底物生成的还原性糖,可在煮沸条件下与DNS显色剂生成棕红色的氨基化合物。在一定范围内,还原糖的生成量与反应液的颜色强度成正比。该法操作简便,显色稳定,重现性好,且无需特殊的仪器设备,是众多科研单位公认的木聚糖酶检测方法[7-10]。
1试验
1.1仪器设备
电子天平(精度0.000 1g),pH计,可见分光光度计,恒温振荡水浴锅,秒表,刻度试管,移液管,容量瓶,烧杯。
1.2材料
木聚糖(Sigma公司),D(+)-木糖(国药集团化学试剂有限公司),木聚糖酶、淀粉酶、纤维素酶、果胶酶、脂肪酶(诺维信公司),3,5-二硝基水杨酸(DNS),酒石酸钾钠,苯酚,偏重亚硫酸钠,磷酸氢二钠,磷酸二氢钾,醋酸,醋酸钠,氢氧化钠,十二烷基磺酸钠、十二烷基苯磺酸钠、平平加O、EDTA、JFC、阳离子助剂、硫酸铝、硫酸亚铁、硫酸锰。
1.3试剂与溶液的配制
(1)DNS试剂
取3,5-二硝基水杨酸7.5 g,充分溶解于500 mL蒸馏水(蒸馏水先沸煮10 min后,冷却近室温)中,逐步加入14 gNaOH。随后,分别依次加入216 g酒石酸钾钠,5.5 mL苯酚(50℃水浴溶解),6 g偏重亚硫酸钠(溶解过程中可加入适量蒸馏水)。待其充分溶解后,定容至1 000 mL,放入棕色瓶中静置1~5 d,待用。溶液每月配制一次,平时使用时可倒少量于小瓶中,其余放入冰箱中静置。
(2)0.25 g/LD(+)-木糖
用电子天平准确称取0.025 g木糖,充分溶解后,定容至100 mL。
(3)pH值缓冲溶液
分别取不同量的磷酸氢二钠和磷酸二氢钾,用pH计配制pH值为5,6,7和8.8的缓冲溶液。同理,pH值为4的缓冲液采用醋酸缓冲液配制,pH值为10的缓冲液采用碱性缓冲液配制。
(4)木聚糖底物
采用相应的pH缓冲液配制。
1.4DNS法酶活测定
1.4.1D-(+)-木糖标准曲线的绘制
在刻度试管中加入2.0、2.5、3.0、3.5、4.5和5.5 mL的0.25 g/LD-木糖溶液,再分别加入DNS试剂5.0 mL,加蒸馏水分别定容至12 mL。加热至沸,保持8 min,充分显色,冷却后定容至25 mL。在另一容量瓶中加入5.0 mL DNS试剂,定容至25 mL,作为参比溶液。在540 nm处,测定各溶液的吸光度,并以D-木糖质量浓度C为横坐标,以吸光度A为纵坐标,绘制标准曲线。
A=m・C+n(1)
式中:A―――溶液吸光度
m―――绘制的标准曲线的斜率
C―――D-木糖质量浓度
n―――绘制的标准曲线的截距
1.4.2木聚糖酶酶活测定
试验中,1 mL酶在一定温度和pH值条件下,1 h分解木聚糖产生1mgD(+)-木糖,视为一个酶活力单位U。
取1 mL经稀释的酶液,加入5 mL缓冲溶液,沸煮10 min(灭活木聚糖酶)后加入底物木聚糖溶液。处理一定时间后,加入DNS显色8 min,得到参比液。另取木聚糖溶液1 mL于刻度试管中,加入不同pH值的缓冲溶液5 mL,在一定温度的水浴中平衡5 min。加入稀释后的木聚糖酶溶液1 mL,摇匀并开始计时。酶处理t时间后,迅速加入DNS试剂5 mL,并将刻度试管放入沸水浴中显色8 min,冷却,定容至25 mL。以参比液为空白,采用分光光度计在540 nm下测定溶液吸光度。如果吸光度过大,可以进行适当稀释后测试。按式(3)计算酶活。
C=(A-n)/m(2)
U=(C×0.025 L)/(t×1 mL)(3)
式中:C―――生成木糖的质量浓度(mg/L)
A―――溶液吸光度
U―――木聚糖酶酶活
0.025 L―――显色后定容体积
t―――酶反应时间(h)
1 mL―――木聚糖酶体积
2结果与分析
2.1酶稀释倍数的影响
将1 mL木聚糖酶分别以蒸馏水稀释100~10 000倍,并于缓冲溶液pH值8、反应温度60℃、反应时间30 min条件下测定酶活,见图1。
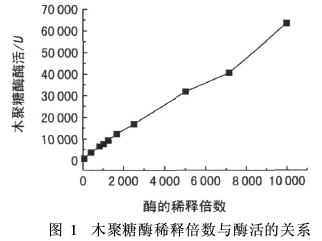
理论上,酶的活力与其稀释倍数无关,即不同稀释倍数下测得的酶活为定值[11]。但图1中,酶的稀释倍数不同,测得的酶活也不相同。这可能是由于底物木聚糖的浓度与酶的浓度不适应引起的。由于木聚糖的浓度相对很低,酶的稀释倍数在10 000以内时,酶的浓度仍然相对太大,底物木聚糖可全部被水解。这种情况下,酶的稀释倍数越大,酶活越高。但需要强调的是,稀释倍数很大,会导致较大的滴定误差。所以,本试验中稀释10 000倍后不再继续稀释。
2.2底物用量的影响
取1、2、3、4、5和6 mL 10.00 g/L木聚糖溶液于6个刻度试管中,然后依次向各试管中加入5、4、3、2、1和0 mL pH值为8的缓冲溶液。在60℃水浴中平衡5 min,加入稀释5 000倍和10 000倍的木聚糖酶溶液1 mL,反应30 min,其余操作参照酶活测定方法。结果如图2所示。
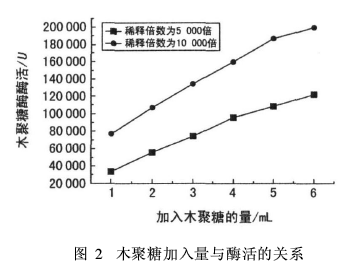
由图2可以看出,木聚糖酶酶活与底物用量呈线性关系,底物用量越多,酶活越大。加入同量的木聚糖底物,酶溶液稀释10 000倍时所测得酶活比稀释5 000倍高一倍。但是,由于底物本身并非为澄清溶液,底物用量增加会影响其吸光度的测量。因此,底物的加入量不宜过多。
2.3木聚糖酶处理时间
取10 g/L木聚糖2 mL(酶稀释10 000倍和5 000倍)或4 mL(酶稀释10 000倍),水浴温度60℃,缓冲溶液pH值8,酶处理时间2~40 min。测试不同处理时间下的木糖生成量和酶活,结果见图3和图4。
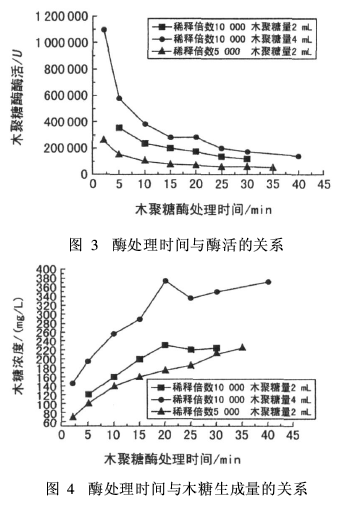
从图3可以看出,木聚糖酶处理时间越短,计算得到的酶活越大。酶稀释10 000倍、木聚糖加入量为2 mL时,酶处理2min,酶活计算值可达1.1×106;酶处理时间为5 min时,酶活计算值为1.7×105,变化明显。酶处理时间为2~15 min,酶活计算值差异较大;酶处理时间超过15 min,酶活的计算值变化逐渐减小。在底物分解速率呈线性条件下选择酶处理时间比较适宜。图4中,酶处理时间0~20 min,木糖的生成速率大致在线性范围内;酶处理时间为20~30 min,木糖浓度增加趋缓。综上,选择酶处理时间为20 min。
2.4木聚糖酶pH值
木聚糖酶用量1 mL(稀释倍数5 000),5 g/L木聚糖1 mL,酶处理温度60℃,酶处理时间20 min。调节酶溶液pH值为4、5、6、8、8.8和10,考察pH值对木聚糖酶酶活的影响,见图5。
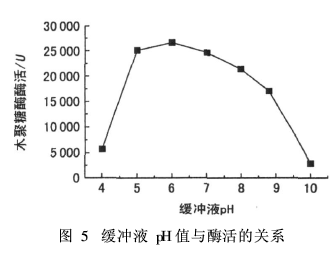
由图5可以看出,木聚糖酶pH值为6时,其活性最高;pH值为5、7和8.8时,木聚糖酶也都保持较高的活力;pH为4和10时,木聚糖酶处理木聚糖的活力降低,说明酸性或碱性过强都会影响酶的活力。木聚糖酶较佳pH值为6。
2.5木聚糖酶最佳反应温度
木聚糖酶用量1 mL(稀释倍数5 000),5 g/L木聚糖1 mL,酶处理时间20 min,缓冲溶液pH值8。分别在温度50、60、70、80和90℃下考察木聚糖酶的活力,见图6。
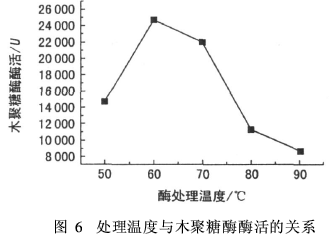
由图6可见,木聚糖酶的较佳反应温度为60℃;处理温度为50和70℃时,木聚糖酶也保持有较高的活力;但温度为80和90℃时,酶的活力降低比较明显。因此,木聚糖酶的处理温度以50~70℃为佳。
2.6木聚糖酶恒温稳定性
各取1 mL木聚糖酶液(稀释5 000倍)于刻度试管中,分别加入5mL pH值为6的磷酸缓冲液和pH值为8(Na2CO3和自来水调节)的缓冲溶液,于60℃水浴中恒温稳定1~6 h;随后加入5 g/L木聚糖溶液1 mL,酶处理20 min,加入DNS显色测定酶活。结果如图7和图8所示,以恒温稳定0 h得到的酶活为100%。
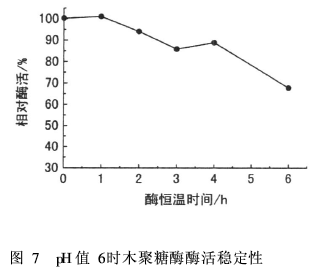
由图7可知,pH值为6时,木聚糖酶在60℃恒温0~4 h,相对酶活都在85%以上,稳定性较好;恒温保持6 h,相对酶活<70%,酶活下降明显。
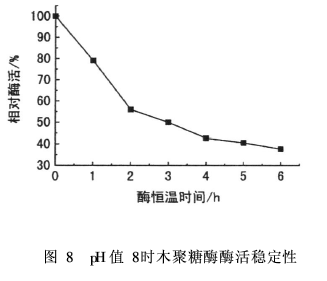
图8中,pH值为8时,随着恒温时间的增加,木聚糖酶的相对酶活下降明显,3~6 h内其相对酶活降至50%以下。因而,在纺织印染前处理应用中,需充分注意木聚糖酶的稳定时间,尽量在酶加入的1~2 h就予以使用。否则,木聚糖酶的活力会降低。
2.7其它前处理用酶制剂的影响
在纺织品生物酶处理中,根据前处理工艺的需要,常出现不同种类的酶剂共存的情况。这时,不同酶种对木聚糖酶活力的影响程度,将直接影响到酶种选择及前处理效果。针对这一问题,选择用于棉织物前处理的脂肪酶、纤维素酶、果胶酶和淀粉酶等5种生物酶进行研究。结果见表1和表2。
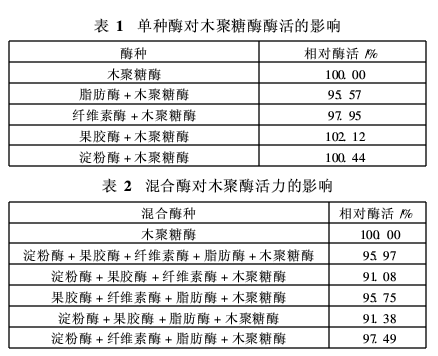
由表1和表2可以看出,淀粉酶、果胶酶、纤维素酶、脂肪酶及其混合酶对木聚糖酶的活力没有太大的影响。各混合酶的相对活力都在90%以上。因而,在印染前处理中,木聚糖酶与淀粉酶、果胶酶、纤维素酶和脂肪酶都能共存。
2.8化学助剂的影响
生物酶前处理中,除了不同种类酶制剂相互混合外,还需加入渗透剂等表面活性剂。为了提高酶活力,减少原酶用量,研究了表面活性剂以及金属离子对木聚糖酶活力的影响,结果见表3和表4。
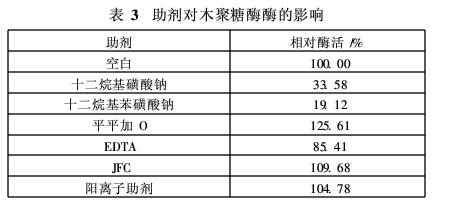
由表3可知,阴离子表面活性剂十二烷基磺酸钠和十二烷基苯磺酸钠对木聚糖酶的活力起抑制作用,可将相对酶活分别降低到33.58%和19.12%。非离子表面活性剂平平加O和JFC则对木聚糖酶的活力有很好的促进作用。另外,阳离子助剂对木聚糖酶的活力也有促进作用;EDTA会降低木聚糖酶的活力,但降低程度有限。
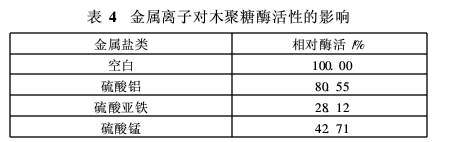
从表4可以看出,本试验选取的金属离子对木聚糖酶的活力均有抑制作用。亚铁离子对木聚糖酶的活力影响最大,其次为锰离子,铝离子的抑制作用较小。
2.9参比液的影响
采用DNS法测试木聚糖酶酶活的过程中,会根据木聚糖酶作用条件的变化选择不同的参比液,虽然各参比液之间的差别并不是很明显。为减少试验中制作参比液的工作量,对木聚糖酶不同作用条件下参比液的吸光度进行比较。
制作参比液时,向1 mL灭活的木聚糖酶酶液(稀释倍数5 000)中加入5 g/L缓冲液5 mL以及1 mL木聚糖底物,在一定温度下反应20 min后,加入5 mLDNS试剂,沸煮8 min,使其充分显色。选取不同类型的参比液,以蒸馏水作空白,测量其在540 nm波长下的吸光度,见表5和表6。
由表5和表6可以看出,不同pH值缓冲溶液、反应温度参比液的吸光度均为0.03~0.04,在测量误差范围内,说明参比液没有太大的影响。因而,在测定过程中,可以适当地用一个pH值的缓冲溶液、同一个反应温度作为参比液,无需每个pH值和反应温度都制备参比液。
3结论
(1)木聚糖酶的活力随着酶稀释倍数和底物木聚糖加入量的提高而增加,但二者不能无限增加,否则会引起测量误差。本试验最终选取酶的稀释倍数为5 000,5 g/L底物木聚糖溶液用量1mL;酶处理反应时间20 min,pH值6,反应温度60℃。
(2)木聚糖酶在pH=6磷酸缓冲体系60℃恒温保持0~4 h,其相对酶活在85%以上,稳定性很好;时间超过6 h,酶活下降明显。在pH=8(Na2CO3+自来水调节)条件下,3~6 h内,相对酶活会下降至50%以下,相对酶活下降明显。
(3)淀粉酶、果胶酶、纤维素酶和脂肪酶等对木聚糖酶的活力影响均不明显。
(4)对于木聚糖酶的活力,阴离子表面活性剂十二烷基磺酸钠和十二烷基苯磺酸钠起抑制作用;非离子表面活性剂平平加O、JFC则起到了很好的促进作用;阳离子助剂也有促进作用;EDTA起抑制作用,但效果不明显。
(5)金属离子中,亚铁离子对木聚糖酶的酶活影响最大,锰离子次之,铝离子的抑制作用较小。
(6)不同pH值缓冲溶液和不同反应温度的参比液,其吸光度差别不大。因而,为减少操作量,试验中,参比液可以选取同一种缓冲溶液和同一个反应温度。
参考文献:
[1]靳贺玲,范雪荣,王强.响应面分析法优化棉针织物的国产碱性果胶酶精练工艺[J].江南大学学报(自然科学版),2006,4:229-231.
[2]阎贺静,华兆哲,堵国成,等.碱性木聚糖酶降解棉籽壳的热动力学[J].印染,2009,35(19):1-4.
[3]CsiszárE,SzakácsG,Koczka B.Biopreparation of cotton fabricwithenzymes produced by solid-state fermentation[J].EnzymeMicrob.Techno.l,2007(40):1765-1771.
[4]Collins Gerday C,Feller G.Xylanases,xylanases families and ex-tremophilic xylanases[J].FEMSMicrobiolRev,2005,29(1):3-23.
[5]李彩霞,房桂干,刘书钗.木聚糖酶酶活的具体测定方法[J].林产化工通讯,2001,35(1):20-23.
[6]罗长才,李莲,刘亚力,等.琼脂扩散法测定加酶饲料中微量纤维素酶活力的研究[J].饲料工业,2003,24(10):39-41.
[7]禹慧明,林勇,徐有良,等.常用饲用酶制剂测定方法的比较[J].广东饲料,2002,11(3):25-28.
[8]李富伟,汤海鸥,汪勇.不同条件下木聚糖酶稳定性研究[J].中国饲料,2008(15):27-29.
[9]冯培勇,左言美,袁腾飞,等.木聚糖酶活性测定方法的研究[J].生命科学仪器,2009,4(7):40-42.
[10]李清峰,马向东,于锋.不同运输条件下液态木聚糖酶的稳定性研究[J].饲料工业,2009,30(10):15-17.
[11]张娟,王莹,王博.果胶酶活力与稀释倍数的测定与研究[J].陕西农业科学,2009(2):54-56.
(责任编辑:)
